
Biologische Themen > Biomembranen > Polare und unpolare Moleküle
| Polare Moleküle haben in sich ein Ungleichgewicht, was die Verteilung der Bindungselektronen betrifft. Das Atom mit der größeren Elektronegativität zieht die Bindungselektronen stärker an sich. Es entsteht dort der negative Pol. Am gegenüberliegenden Ende befindet sich dann der positive Pol. Man spricht von einer polaren Atombindung. |
| Wichtigstes Beispiel: Das Wassermolekül |
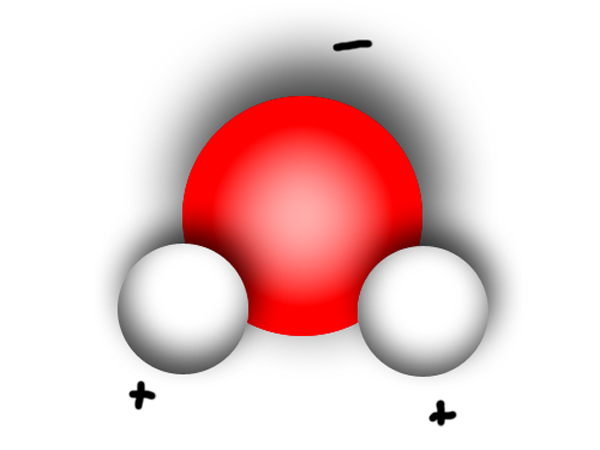 |
| Andere polare Stoffe: Stoffe mit einer OH-Gruppe (= Hydroxyl-Gruppe), Stoffe mit einer COOH-Gruppe (= Carboxyl-Gruppe), Stoffe mit einer NH2-Gruppe (=Aminogruppe). |
| Da sich diese Stoffe sehr gut in Wasser lösen lassen, nennt man sie hydrophil. |
| Unpolare Moleküle enthalten Elemente mit annähernd gleicher Elektronegativität, es kommt in der Bindung zu keiner wesentlichen Verschiebung von Elektronen. |
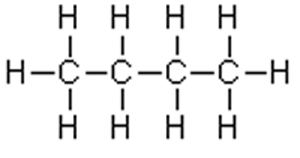 |
| In derartigen Kohlenwasserstoffketten gibt es keine Polarität. Unpolare Stoffe lassen sich in unpolaren Lösungsmitteln lösen. Wasser gegenüber reagieren sie abweisend, also hydrophob. |
| Hierher gehören Öle, Fette, Alkane. |
| Nun gibt es aber auch Stoffe mit einem hydrophilen Anteil und einem hydrophoben Anteil, wie zum Beispiel Ethanol (Alkohol). |
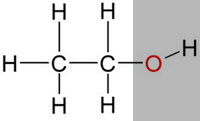 |
| Daher ist Ethanol gut in Wasser löslich, kann aber auch Fett lösen. |